Dominar alguns conceitos físicos é fundamental para obter uma compreensão abrangente dos anestésicos inalatórios. Portanto, vamos relembrar o que são pressão de vapor e ponto de ebulição.
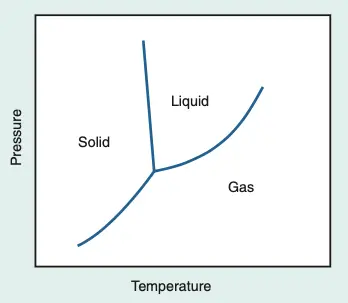
Os anestésicos inalatórios mantêm-se em estado líquido sob condições de temperatura e pressão ambiente, à exceção do desflurano. Porém, por serem líquidos voláteis, apresentam a capacidade de transitar facilmente do estado líquido para o estado gasoso. Essa transição pode ser mais bem compreendida ao observar o diagrama de fases apresentado abaixo.
em uma determinada temperatura, uma matéria pode existir na sua fase líquida e de vapor ao mesmo tempo.
Quando esses líquidos voláteis são contidos em um recipiente fechado, suas moléculas alcançam um equilíbrio entre as fases líquida e gasosa. Nesse equilíbrio, a volatilização é compensada pela liquefação das moléculas, o que significa que para cada molécula que se volatiliza, outra se liquefaz. As moléculas de vapor colidem com as paredes do recipiente e com o líquido, exercendo o que conhecemos como pressão de vapor. A volatilidade de um líquido está diretamente relacionada à sua pressão de vapor, assim, quanto mais elevada é a pressão de vapor, maior é a volatilidade do líquido.
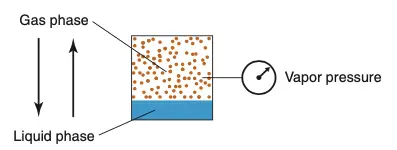
Pressão de vapor
Uma propriedade importante da pressão de vapor é que ela independe do volume do líquido. No entanto, como qualquer gás, a pressão de vapor varia com a temperatura. Quanto mais alta a temperatura, maior será a pressão de vapor. Portanto, a pressão de vapor é influenciada por dois fatores fundamentais: as características intrínsecas da substância (massa, estrutura molecular…) e a temperatura ambiente.
Em condições de temperatura ambiente, a maioria dos anestésicos inalatórios possui pressões de vapor inferiores à pressão atmosférica. No entanto, à medida que a temperatura se eleva, a pressão de vapor também aumenta.
Pressão de ebulição
O ponto de ebulição de um líquido é a temperatura na qual sua pressão de vapor ultrapassa a pressão atmosférica em um recipiente aberto, resultando na sua transformação para o estado gasoso.
Pressão de vapor e ponto de ebulição à temperatura (20 ° C) e pressão (1 atm ou 760 mmHg) ambiente

O desflurano se destaca por seu ponto de ebulição de 23,5 °C e uma pressão de vapor extremamente próxima à pressão atmosférica. Portanto, exige armazenamento especial, pois sob condições de temperatura ambiente, seu ponto de ebulição é atingido. A ebulição é evitada dentro do recipiente próprio devido ao aumento da pressão de vapor. Porém, uma vez aberto, o desflurano entra em ebulição rapidamente, tornando essencial o uso de vaporizadores específicos para sua administração.
Fontes Bibliográficas:
- Barash PG, Cullen BF, Stoelting RK, Cahalan MK, Stock MC, Ortega R. et al. Anestesiologia Clínica. 8. Ed.. Philadelphia, PA: Wolters Kluwer, 2018.
- Cangiani LM, Slullitel A, Potério GMB, Pires OC, Posso IP, Nogueira CS, et al. Tratado de anestesiologia. 7. ed. São Paulo: Atheneu, 2012.
- Ebrahim H, Ashton-Cleary D. Maths, physics and clinical measurement for anesthesia and intensive care. Cambridge, United Kingdom: Cambridge University Press, 2019
- Hemmings HC Jr, Egan TD. Pharmacology and physiology for anesthesia. 2th ed. Philadelphia, PA: Elsevier, 2019.





