Embora este não seja um tópico central na anestesia, entender os estados físicos e as transições da matéria é de grande relevância para uma melhor compreensão das propriedades físicas dos anestésicos inalatórios e dos gases medicinais.
A matéria pode se manifestar em três fases distintas: sólida, líquida e gasosa. A diferença fundamental entre esses estados está relacionada à energia cinética das moléculas e ao grau de interação entre elas.
- Sólido: caracterizado por sua rigidez estrutural, o que implica em formas e volumes definidos. As partículas encontram-se bastante próximas e organizadas, permanecendo imóveis. Além disso, não podem ser comprimidas. Ex: gelo.
- Líquido: possui um volume definido, embora sua forma seja variável. As forças de atração entre as partículas são menos intensas em comparação ao estado sólido, resultando em uma maior mobilidade e menos organização. Assim como os sólidos, não podem sofrer compressão. Exemplo: água.
- Gás: distingue-se por não possuir forma nem volume definidos, adotando a forma do recipiente que o contém, independente de sua quantidade. As partículas estão amplamente separadas, apresentando grande liberdade de movimento e desorganização. A energia cinética molecular dos gases é tão alta que as interações intermoleculares são consideravelmente menos significativas. Consequentemente, eles podem ser comprimidos e expandidos. Exemplo: oxigênio.
Transição da matéria
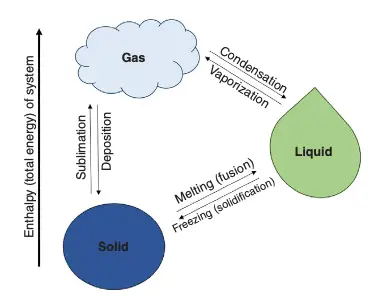
A matéria pode transitar de um estado para outro sem, contudo, alterar sua natureza química, alterando apenas a organização de suas partículas. Os principais fatores que influenciam essa transição são a pressão e a temperatura.
Para uma compreensão mais profunda dessa transição, podemos recorrer ao diagrama de fases da matéria, o qual ilustra a variação dos estados físicos de uma substância em função de mudanças na pressão e temperatura.
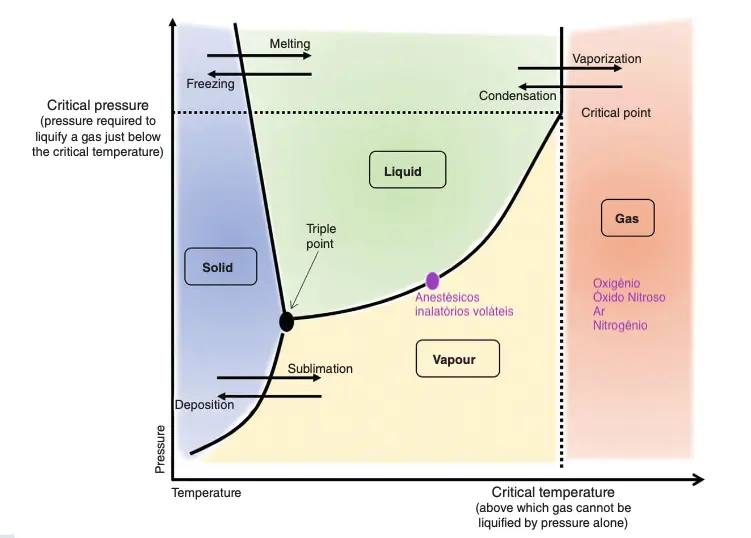
É notável que existem pontos no gráfico onde uma substância pode coexistir em duas fases, em equilíbrio. Isso é particularmente evidente com os anestésicos inalatórios voláteis, que, sob temperatura e pressão ambiente (1 atm e 20oC), podem existir tanto na fase líquida quanto na fase de vapor.
Qual é a diferença entre gás e vapor?
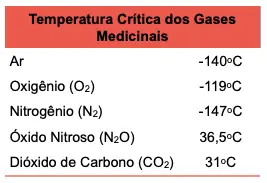
O conceito de temperatura crítica desempenha um papel fundamental nessa distinção. A temperatura crítica é aquela na qual uma substância não pode existir simultaneamente como líquido e vapor, em equilíbrio térmico, independente da pressão. Acima dessa temperatura, a substância se encontra no estado gasoso, e uma transição para o estado líquido só é possível mediante a diminuição da temperatura (abaixo da temperatura crítica) com aumento da pressão. Exemplos de gases em nossa prática anestésica incluem o oxigênio, o óxido nitroso e o ar, enquanto anestésicos inalatórios voláteis são exemplos de vapores.
Podemos observar esse conceito na prática, especialmente no armazenamento de gases medicinais. O oxigênio, por exemplo, pode ser armazenado de duas maneiras: como gás comprimido, à temperatura ambiente, ou na forma líquida, sob alta pressão e abaixo de sua temperatura crítica (-119°C).
Fontes Bibliográficas:
- Barash PG, Cullen BF, Stoelting RK, Cahalan MK, Stock MC, Ortega R. et al. Anestesiologia Clínica. 8. Ed.. Philadelphia, PA: Wolters Kluwer, 2018.
- Cangiani LM, Slullitel A, Potério GMB, Pires OC, Posso IP, Nogueira CS, et al. Tratado de anestesiologia. 7. ed. São Paulo: Atheneu, 2012.
- Ebrahim H, Ashton-Cleary D. Maths, physics and clinical measurement for anesthesia and intensive care. Cambridge, United Kingdom: Cambridge University Press, 2019
- Hemmings HC Jr, Egan TD. Pharmacology and physiology for anesthesia. 2th ed. Philadelphia, PA: Elsevier, 2019.


